LHF Espoir a financé des travaux de recherche menés par les équipes de Grégoire Michaux à l’Université de Rennes qui avaient pour but de tester l’effet d’un traitement au LPA (Acide Lysophosphatidique) sur les défauts cellulaires induits par la mutation du gène MUNC18-2. La synthèse du projet et les résultats sont présentés ci-dessous.
Équipe
Anne Bourdais, Ophélie Nicolle, Aurélien Bidaud-Meynard, Grégoire Michaux
Univ Rennes, CNRS, IGDR (Institut de Génétique et Développement de Rennes) – UMR6290, F-35000 Rennes, France

Contexte de l’étude
MUNC18-2 est l’un des gènes responsables de la Lymphohistiocytose Familiale de type 5 (FHL5). Plus précisément, il a été démontré que la protéine MUNC18-2 codée par le gène STXBP2 entraîne des troubles digestifs aux enfants portant cette mutation génétique.
MUNC18-2 intervient dans la formation du pôle apical des cellules épithéliales, c’est-à-dire les cellules qui bordent la surface (externe) du corps et des organes. En conditions normales, ce gène permet la formation de la surface d’échange de l’épithélium de l’intestin, appelée bordure en brosse qui permet l’absorption des aliments. C’est dans la bordure en brosse que sont insérés plusieurs transporteurs nécessaires à l’absorption des aliments et à la régulation des mouvements d’eau et d’électrolytes entre le tube digestif et le reste du corps. Une mutation du gène MUNC18-2 entraînerait donc, chez le patient porteur, une malabsorption des nutriments et des diarrhées chroniques. Ce patient dépend alors d’une nutrition parentérale toute sa vie (la nutrition parentérale est une méthode médicale qui consiste à apporter des éléments nutritifs par voie intraveineuse directement dans le sang).
Lien avec le gène MYO5B
Ces défauts structuraux et fonctionnels de la bordure en brosse sont également retrouvés chez des patients atteints par la maladie des inclusions microvillositaires (MVID). Un des gènes majeurs impliqués dans cette pathologie est le gène MYO5B.
MYO5B code une protéine de type moteur moléculaire qui sert au transport des vésicules vers la bordure en brosse des cellules intestinales. Les vésicules s’accumulent sous cette membrane quand le gène MYO5B est muté.
Les protéines MYO5B et MUNC18-2 sont ainsi impliquées dans une même voie de trafic intracellulaire, ce qui explique les similitudes entre les symptômes observés dans la MVID et la LHF au niveau intestinal (Dhekne et al., Human mutation 2018).
L’effet du LPA
Récemment, Kaji et al. [Gastroenterology 2020] ont montré que l’acide lysophosphatidique (ou LPA) permet de restaurer partiellement la bordure en brosse des cellules intestinales chez la souris déficiente pour la protéine Myo5b (qu’on appelle Myo5b-KO), et également dans le modèle organoïde intestinal Myo5b-KO. Les modèles organoïdes intestinaux sont des mini-reproductions de l’intestin humain ou de souris cultivées en laboratoire, utilisées pour étudier le fonctionnement et les maladies intestinales. En effet, après traitement au LPA, la taille des microvillosités est augmentée et la localisation apicale de marqueurs de la bordure en brosse (tels que le co-transporteur Na+/Glucose SGLT1, le transporteur Na+/H+ NHE3 ou encore l’enzyme de dégradation DPPIV) est partiellement restaurée.
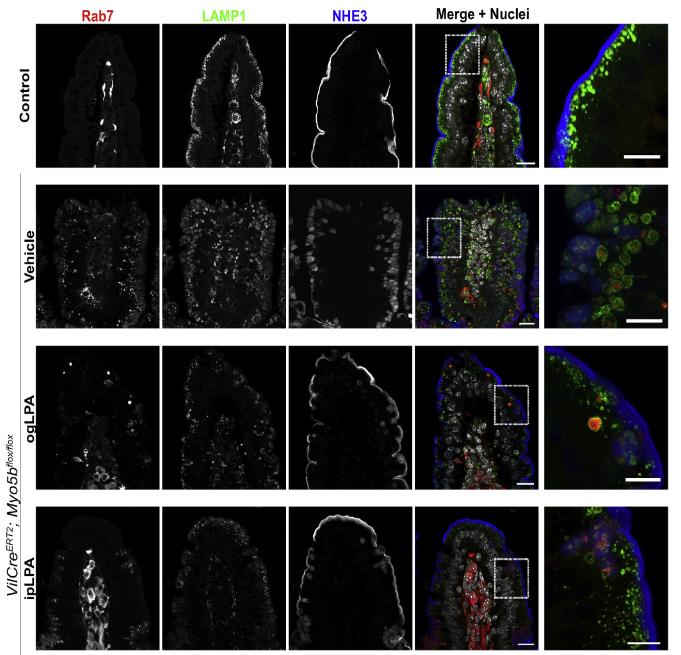
Figure 1 : Des souris Myo5b KO ont reçu un traitement au LPA par injection intra-péritonéale (ip) ou par gavage (og). On observe un retour du transporteur NHE3 à la membrane après traitement (ogLPA, ipLPA), signe d’une amélioration du trafic et du transport des vésicules à la membrane apicale de la cellule. [Kaji et al., 2020]
Les hypothèses du projet de recherche
Les recherches menées par les équipes de Grégoire Michaux à l’Université de Rennes avaient pour but de tester l’effet d’un traitement au LPA sur des organoïdes murins déficients pour Munc18-2, et de déterminer s’ils arrivent à corriger certains défauts de structure.
Pour cela, les chercheurs ont utilisé deux types d’organoïdes intestinaux :
- Des lignées cellulaires déficientes en Myo5b (Myo5b KO inductible) générée par CRISPR-Cas9
- Des lignées d’organoïdes déficientes pour Munc18-2 (Munc18-2 KO)
Dans chaque lignée, ces déficiences entrainent la présence de défauts de structure et de fonction dans la bordure en brosse des organoïdes.
Résultats
1/ Après avoir injecté du LPA à une concentration importante pendant 48 heures, au cours de la différenciation des organoïdes (c’est à dire au moment où la bordure en brosse se forme et se différencie du reste de l’intestin), les chercheurs ont observé la formation d’inclusions microvillositaires (MVI) et les ont quantifiées.
- Après analyse, 60 à 70% des organoïdes Myo5b KO (traités ou non par le LPA) présentent des MVIs.
- Concernant les organoïdes Munc18-2 KO, 30 à 40% des organoïdes (traités ou non par le LPA) ont des MVI.
On peut en conclure que le LPA n’empêche pas la formation de MVI dans des organoïdes Munc18-2 KO.
2/ En parallèle, des observations en microscopie électronique à transmission (MET) ont été faites afin d’étudier l’effet du LPA sur la bordure en brosse et sur le trafic apical.
- Après analyse et quantification, les chercheurs n’ont pas observé d’effet du traitement LPA sur la bordure en brosse. En effet, les microvillosités de la bordure en brosse restent plus petites et plus larges comparées à celles d’organoïdes contrôles, que ce soit pour les organoïdes Myo5b KO et Munc18-2 KO.
- De plus, les vésicules s’accumulent sous la bordure en brosse en présence ou non de LPA ; le trafic apical n’est donc pas corrigé dans les 2 lignées.
3/ N’ayant pas observé d’effet à une concentration de 5 μM pendant 48h, les chercheurs ont ensuite testé différentes concentrations de LPA (5 μM, 10 μM, 25 μM) sur la lignée Myo5b et différents temps de traitement (48h, 72h) afin de tenter d’optimiser une potentielle correction des défauts cellulaires. Une analyse de la localisation du transporteur NHE3 a ensuite été réalisée. Après analyse des images, le traitement à une concentration de 5μM pendant 72h a été choisi pour les manipulations.
Finalement, les chercheurs n’observent pas d’augmentation significative du ratio apical/subapical, ni du ratio apical/cytoplasmique du marqueur NHE3 après traitement au LPA. Il n’y a donc pas d’amélioration du trafic apical dans les organoïdes Myo5b KO et Munc18-2 KO en réponse au LPA.
Conclusion/Perspectives
Suite aux expérimentations réalisées, les chercheurs n’ont pas pu reproduire les résultats publiés par Kaji et al. sur les phénotypes MVID des organoïdes déficients pour Myo5b et n’ont pas pu mettre en évidence un effet correctif du LPA dans le génotype Munc18-2 KO.
Cette différence de résultats pourrait s’expliquer par la méthode de culture des organoïdes, qui diffère légèrement par rapport à celle des expériences de Kaji et qui ne leur a peut-être pas permis de déterminer la fenêtre d’action du LPA.
Il faut quand même noter que, d’après les résultats publiés, l’effet thérapeutique potentiel du LPA semble minime au vu de la non prise de poids des souris déficientes pour Myo5b après traitement.
A l’avenir, d’autres voies de traitement sur le modèle organoïde pourront être testées afin de s’assurer que les molécules atteignent bien leur cible.
- « L’organoïde en 3D » est une structure cylindrique fermée et creuse, avec la lumière intestinale en son centre, ce qui peut poser la question de l’accessibilité de la bordure en brosse pour des molécules.
- Alternativement, il serait possible de micro-injecter les organoïdes afin d’apporter le traitement directement dans la lumière intestinale, mimant ainsi l’absorption orale de médicaments.
Une fois ces techniques maîtrisées au sein du laboratoire, l’objectif sera de tester de nouveaux traitements pour induire la repousse des microvillosités composant la membrane apicale et/ou corriger le trafic apical.
L’équipe a également lancé un projet visant à établir de nouveaux modèles d’atrophie microvillositaire (réduction des microvillosités avec perte de leur fonctionnement), et à mieux caractériser les mécanismes de ces atrophies à la fois chez C. elegans et dans les organoïdes intestinaux de souris, dans le but d’identifier de nouvelles cibles thérapeutiques.

